Anfang Dezember 2016 fand in San Diego mit 27.000 Teilnehmern der Amerikanische Hämatologenkongresses (ASH) statt. Wir waren mit vier Ärzten, bzw. Biologen vor Ort und haben uns über aktuelle Studien informiert und Methoden mitgebracht, die in Zukunft für unsere Institute eine größere Rolle spielen werden. Mit den neuesten Entwicklungen bei PD-L1 hat sich Dr. Markus Falk ausführlich befasst.
Immunsystem und Immuntherapie
Das Immunsystem ist entscheidend für die Bekämpfung pathogener Organismen. Eine weitere seiner Funktion wird häufig unterschätzt: die Kontrolle und die Bekämpfung von Tumorzellen.

Paul Ehrlich, 1854-1915, gilt als „Vater der Tumorimmunologie“
Schon der Immunologe Paul Ehrlich postulierte „Die Häufigkeit maligner Erkrankungen müsste viel höher sein, wenn der Körper nicht in der Lage wäre, entartete Zellen zu eliminieren“. Dieses Postulat entstand viele Jahrzehnte bevor genauere Erkenntnisse zum Immunsystem oder zur Tumorbiologie vorlagen. Man kann davon ausgehen, dass im gesunden Menschen ein täglicher Kampf des Immunsystems gegen entartende oder bereits entartete Zellen stattfindet. Die Frage nach der Entstehung von Krebserkrankungen ist daher auch immer eng mit der Konstitution des Immunsystems verknüpft.
Therapeutisch versucht man bereits seit mehr als 30 Jahren, das Immunsystem im Kampf gegen eine Krebserkrankung zu unterstützen. Ohne genauere Kenntnis über das komplizierte Zusammenwirken eines aus sehr vielen unterschiedlichen Zelltypen bestehenden Immunsystems hielten sich die Erfolge anfänglich allerdings in Grenzen. Aber immerhin: bei einer kleinen Anzahl von Patienten (ca. 15%) konnte ein längerfristiger Therapieerfolg erzielt werden, allerdings teils zum Preis erheblicher Nebenwirkungen, die auf den Einsatz der relativ „groben Waffe“ Interleukin-2 (IL-2) zurückzuführen war. Rückblickend ist der Grund für diesen hohen Preis einleuchtend: IL-2 ist der entscheidende Wachstumsfaktor für T-Lymphozyten. Und zwar für alle T-Zell-Subtypen. IL-2, in hoher Dosis verabreicht, aktiviert praktisch alle T-Zellen im Körper, die durch Kreuzreaktivität auch gesunde Zellen bekämpfen und damit Organe schädigen. Dieser Ansatz erwies sich also als zu kurz gedacht, obwohl das Prinzip generell sinnvoll war. Es brauchte aber noch einige Jahrzehnte an Grundlagenforschung, um den „Vorschlaghammer“ IL-2 durch die Präzisionswerkzeuge Anti-CTLA-4-Antikörper bzw. Anti-PD-L1-Antikörper zu ersetzen. Die Zulassung dieser Antikörper als therapeutische Option ist ein beeindruckendes Beispiel für die Umsetzung von Erkenntnissen der Grundlagenforschung in die Therapie.
Was geschieht, wenn das Immunsystem in Krebspatienten versagt?
Das bekannteste und derzeit am meisten akzeptierte Konzept lieferten die Autoren um Gavin P. Dunn. Es wurde als „Die drei „E’s“ der Tumorimmunabwehr publiziert 1. Die Autoren beschreiben aufgrund der Datenlage drei Phasen auf dem Wege zum Scheitern des Immunsystems. In der ersten Phase „Elimination“ erfolgt noch eine weitgehend erfolgreiche Immunantwort auf entstehende Tumorzellen. In dieser Frühphase des Tumorwachstums sind Immunzellen im Prinzip noch in der Lage, Tumorzellen zu eliminieren. Im weiteren Verlauf beginnt eine Phase des Equilibriums. Hier entwickelt sich eine Selektion derjenigen Tumorzellen, die aufgrund bestimmter Merkmale (z.B. PD-L1-Expression) in der Lage sind, der Immunantwort standzuhalten. Diese Phase kann vermutlich viele Jahre andauern. In der darauf folgenden dritten Phase erfolgt der Immunescape, der maligne Zellklon mit akquirierter Resistenz gegen das Immunsystem hat sich etabliert.
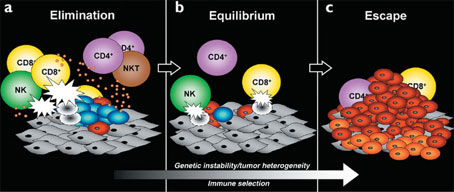
Abb 2:. Nature Immunology 3, 991 – 998 (2002)
Cancer immunoediting: from immunosurveillance to tumor escape
Gavin P. Dunn, Allen T. Bruce, Hiroaki Ikeda, Lloyd J. Old & Robert D. Schreiber
Das Immunsystem, Checkpoints und PD-L1
Auf Grundlage dieses Modells stellt sich allerdings die Frage, warum das Immunsystem die Fähigkeit verliert, Tumorzellen andauernd – wie in der Eliminierungsphase – zu kontrollieren. Die Grundlagenforschung hat in den letzten Jahren Erstaunliches zur Klärung geleistet. Dazu ist ein kurzer Blick in die Details zur Immunzellaktivierung nötig.
Es gibt vor allem zwei sogenannte immunologische Checkpoints, Schlüsselstellen, die für eine effiziente Immunzellaktivierung nötig sind.
CTLA4-Checkpoint, T-Zell-Priming
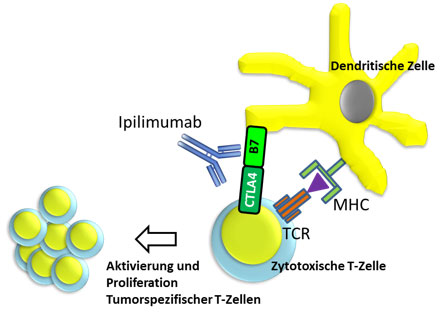
Abb.3: T-Zell Priming im Lymphknoten
Die Abbildung 3 zeigt schematisch die Bedeutung des CTLA-4 Immuncheckpoints.
Dendritische Zellen präsentieren den zytotoxischen T-Zellen ein Tumorantigen. Dadurch wird die tumorspezifische T-Zelle aktiviert und proliferiert, wandert in die Peripherie und kann Tumorzellen attackieren. Zeitgleich mit der Aktivierung wird ein inhibitorisches Signal an die T-Zelle gegeben (B7/CTLA4), um einer Überreaktion des Immunsystems vorzubeugen. Dieser Checkpoint war der erste, der zu therapeutischen Zwecken „ausgenutzt wurde“. 2011 wurde der Antikörper Ipilimumab in den USA zunächst für das metastasierte maligne Melanom zugelassen, später wurde die Zulassung für Europa und für das nicht-kleinzellige Bronchialkarzinom erweitert. Der Anti-CTLA4-Antikörper Ipilimumab verhindert die oben beschriebene Interaktion und führt dadurch zu einer verstärkten tumorspezifischen Immunantwort.
Beispielhaft sind in Abb.4 Langzeitverlaufsdaten beim malignen Melanom gezeigt.
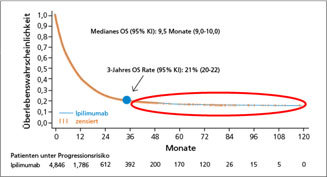
Abb. 4: Gepoolte Analyse von 4846 Melanompatienten behandelt mit Ipilimumab in der Zweitlinientherapie
Die nun auf das Tumorantigen „geprimte“ aktivierte T-Zelle verlässt den Lymphknoten und attackiert die Tumorzelle. Einige Tumoren schützen sich vor diesem Angriff durch die aberrante Expression des inhibitorischen Moleküls PD-L1. Dies ist normalerweise auf antigenpräsentierenden Zellen (z.B. dendritischen Zellen) zu finden, um die periphere T-Zellantwort zu stoppen, wenn diese unnötig geworden ist. Die Tumorzelle hat also „gelernt“ einen Immunsupressor zu bilden, der einer angreifenden T-Zelle ein Anergie-Signal gibt (Abb. 5). Dieses Gegensignal („Tumor-Counterattack“) des Tumors ist einer der Gründe warum es zum Tumorescape (vgl. Abb. 2) kommt.
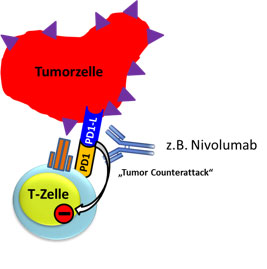
Abb. 5: Schematische Darstellung des PD-L1 vermittelten „Tumor Counterattack“
Auch dieser Immuncheckpoint wird mittlerweile therapeutisch genutzt. So sind die PD-L1 Antikörper Nivolumab und Pembrolizumab für die Zweitlinienbehandlung des NSCLC (plattenepithelial und nichplattenepithelial) und beim Melanom zugelassen. Für die Gabe von Pembrolizumab muss allerdings obligat der PD-L1 IHC-Assay „Dako 22C3 pharmDx“ (companion diagnostic test) durchgeführt werden, wobei die Voraussetzung erfüllt werden muss, dass ≥50% der Tumorzellen PD-L1 positiv gefärbt sind. Für Pembrolizumab wird in Kürze mit einer Zulassung für die First-Line-Therapie beim NSCLC gerechnet und zwar ebenfalls für Patienten deren Tumorzellen zu ≥50% PD-L1 exprimieren (Reck et al., 2016, NEJM). Für Nivolumab gibt es hingegen keine so klare Kategorisierung, hier werden die Abstufungen ≥1%, ≥5% und ≥10% als Beurteilungskriterien herangezogen.
Welche Patienten sprechen auf eine PD-L1-Immuntherapie an?
Die derzeit drängendste Frage ist, wie sich prospektiv Patienten ermitteln lassen, die gut auf eine PD-L1-Immuntherapie ansprechen. Wie beschrieben, sind dies nur etwa 20% aller Patienten. Eine naheliegende Erwartungshaltung war von Anfang an, dass diejenigen Tumoren, die eine besonders hohe PD-L1-Expression nachweisen, auch gut auf die PD1/PD-L1 inhibitorischen Antikörper ansprechen. Folgerichtig wird seit einiger Zeit die Tauglichkeit von PD-L1-Expression auf Tumorzellen als molekularer Marker evaluiert. Dies gestaltet sich – wie erwartet – schwierig. Man muss sich PD-L1 als stark fluktuierendes Oberflächenmolekül vorstellen, das zeitlich dynamisch und keineswegs statisch exprimiert wird. Dabei kann die Immunhistochemie vermutlich nur eine begrenzte Aussagekraft bieten, da sie eine nicht repräsentative Momentaufnahme zeigt. Kann die Immunhistochemie also überhaupt als alleiniger Biomarker für das Ansprechen von Checkpointinhibitoren gelten? In mehreren Studien zur Immuntherapie beim nicht kleinzelligen Bronchialkarzinom wurde beobachtet, dass Patienten mit PD-L1-positiven Tumorzellen eine höhere Ansprechrate und ein längeres Gesamtüberleben hatten, als Patienten ohne PD-L1-Expression 2.
Aber welcher Cutoff ist der geeignetste? Müssen 1%, 50% oder sämtliche Tumorzellen PD-L1 positiv sein um ein optimales Ansprechen zu gewährleisten?
Offenbar können sogar Patienten mit PD-L1 negativen Tumoren (<1% der Tumorzellen PD-L1 positiv) auf eine PD-1 gerichtete Antkörper Therapie ansprechen. Eine fehlende PD-L1-Expression bedeutet also nicht automatisch, dass Patienten nicht von einer Immuntherapie profitieren können 3. Darin unterscheidet sich die PD-L1-Expression von Biomarkern wie dem EGF-Rezeptor, der nur im mutierten Zustand prädiktiv für eine TKI-Therapie ist.
Welcher diagnostische Antikörper bzw. welche Testplattform ist der geeignetste? Es würde an dieser Stelle zu weit führen auf Details einzugehen aber einige Fragen werden in der ersten deutschen Harmonisierungsstudie am nichtkleinzelligen Bronchialkarzinom, an der unser Institut ebenfalls beteiligt war, nachgegangen 4.
Ist die PD-L1-Immuntherapie entitätsübergreifend einsetzbar?
Spätestens beim ASH Meeting im Dezember 2016 in San Diego konnte man die interessante Beobachtung machen, dass das Aktivitätsspektrum der Immuntherapie offenbar entitätsübergreifend ist und über das der soliden Tumoren hinausgeht. Dies wurde unter anderem am Beispiel des Plasmazellmyeloms deutlich. Normale Plasmazellen exprimieren kein PD-L1. Myelomzellen –wie viele andere Krebszellen auch- sehr wohl. Besonders hoch ist das Expressionsniveau von PD-L1 auf Myelomzellen von Patienten im refraktorisch/rezidivierten Szenario und bei Patienten mit einer erhöhten Tumorlast im Knochenmark. Demnach wurde eine erste Phase-I-Studie auch an 27 therapierefraktorischen Patienten durchgeführt. Immerhin bei 63% der Patienten war ein Therapieerfolg (SD, stable disease) zu beobachten.
Interesse am Thema Immunonkologie in den letzten Jahren deutlich gestiegen

Abb. 6: Entwicklung des Publikumsinteresses am Thema Immunonkologie innerhalb weniger Jahre. Abb oben ASH Hörsaal zum Thema Immunonkologie 2013 (Übertreibung) versus 2016 (Bild unten, Realität)
- „The Three Es“ of cancer immunoediting, Dunn GP et al., 2004 Annu Rev Immunol. 2004; 22:329-60 ↩
- Gettinger et al., 2015J Clin Oncol; Garon et al., 2015, NEJM; Fehrenbacher et al., 2016, Lancet; Borghaei et al., 2015, NEJM; Herbst et al., 2015, Lancet ↩
- Brahmer et al., 2015, NEJM; Borghaei et al., 2015, NEJM ↩
- Scheel et al., 2016, Der Pathologe ↩