In der Medizin allgemein bedeutet Krebs eine bösartige Erkrankung. Tumorzellen teilen und vermehren sich unkontrolliert. Für Patient*innen bedeutet Krebs eine schwerwiegende Krankenheit, für den Pathologen/die Pathologin geht es um die Identifikation des Tumortypes und damit um mögliche Behandlungsmethoden. Mit der Artikelreihe „Was ist Krebs“ beleuchten wir das Thema aus sehr unterschiedlichen Perspektiven. Wir beginnen mit der Sicht des Molekularbiologen.
Die Krankheitsbezeichnung „Krebs“ ist ein weiter Begriff und die Frage „Was ist Krebs“ ist schwer zu beantworten. Hier kommt es unter anderem stark auf die Sichtweise an. Für den Wissenschaftler mag Krebs eine spannendes Forschungsobjekt sein. Für einen Pathologen ist Krebs als eine auffällige Zellstruktur im Mikroskop zu erkennen, für den Molekularbiologen zeigt sich Krebs in Form veränderter DNA-Sequenzen. Für die an Krebs erkrankten Patienten und deren Angehörige ist Krebs vermutlich weder spannend noch interessant, sondern körperlich und seelisch stark belastend und für den behandelnden Arzt wiederum eine große therapeutische Herausforderung. Es kommt auf die Perspektive an.
Aus Sicht der Molekularpathologie stellt sich „die Krebserkrankung“ in erster Linie als extrem heterogene Gruppe von Erkrankungen mit denkbar unterschiedlichen genetischen Grundlagen dar.
Die menschliche Zelle besitzt in etwa 20.000 Gene, die auf 46 Chromosomen liegen und insgesamt aus 6 Milliarden einzelnen Bausteinen (Nukleotiden) bestehen. Immer ist bei einer Krebserkrankung zumindest eines dieser Gene mutiert, meistens an Stellen, die bereits bekannt sind aber auch in bislang wenig charakterisierten Regionen. In einigen Fällen kann eine einzige Mutation in einem einzigen Gen ausreichen, um eine Krebserkrankung entstehen zu lassen (zum Beispiel bei der chronischen myeloischen Leukämie, CML). In anderen Fällen können mehrere tausend Genmutationen pro Tumorzelle auftreten. Dies wurde vor allem bei Krebsarten beschrieben, die durch exogene Noxen bzw. Umweltfaktoren begünstigt werden, wie dem malignen Melanom bzw. dem Lungenkarzinom.
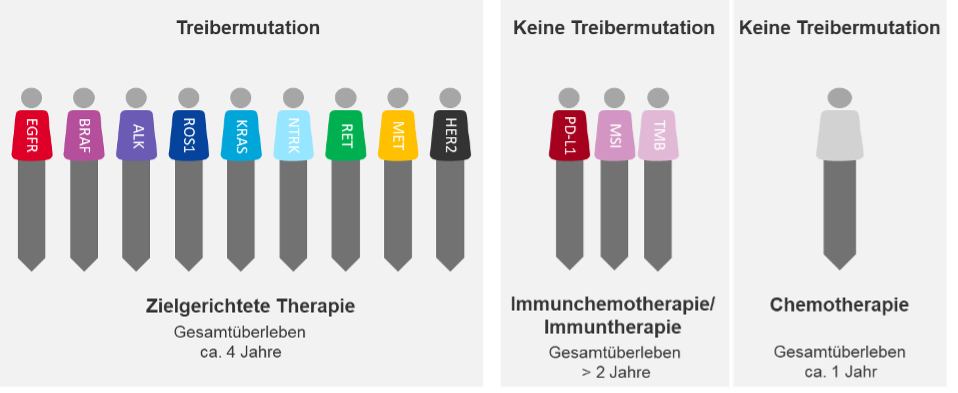
Nicht alle dieser mitunter vielen Mutationen sind für die Krebsentstehung relevant, viele kommen im Laufe der Erkrankung hinzu, denn Tumore sind genetisch instabil und neigen dazu, im Krankheitsverlauf weitere Mutationen anzureichern, sich genetisch zu verändern. Jeder Tumor besitzt eine treibende Kraft aus einem veränderten Enzym, die seine Ursache in einer Genmutation hat, die man Treibermutation nennt. Weitere (Passenger-)Mutationen können zusätzlich vorhanden sein, aber die Treibermutation ist die entscheidende. Durch Sie entsteht ein in seiner Aktivität verändertes Protein. Beim Lungenkarzinom sind bislang etwa zehn solcher Treibergene identifiziert worden.
Aus Sicht des Tumorgenetikers gibt es also nicht „das Lungenkarzinom“, sondern mindestens 10 verschiedene genetische Untergruppen mit entsprechend unterschiedlichem Wachstumsverhalten, Therapieansprechen und unterschiedlicher Prognose. Dies ist vielleicht die entscheidende Erkenntnis der letzten Dekade, denn in etwa seit dieser Zeit können die Treibermutationen, und damit „die Wurzel“ des Übels, diagnostisch ermittelt und behandelt werden mit Hilfe von zielgerichteten Medikamenten, die genau jene Genveränderungen blockieren, die den Krebs mit Energie versorgen.
Im Mittel können mit diesem Therapieansatz etwa 3 bis 4 Jahre Lebenszeit (aufgrund guter Verträglichkeit) unter vergleichsweise hoher Lebensqualität für den Patienten gewonnen werden.
Dieses Ergebnis muss man in Relation zur Chemotherapie sehen, die jahrzehntelang die einzige Therapiemöglichkeit im fernmetastasierten Stadium war. Hier konnten lediglich etwa 12 Monate Lebensdauer ab Therapiebeginn erzielt werden, und das bei den bekannten, teils erheblichen und alltagseinschränkenden, Nebenwirkungen.
Es ist erstaunlich, wie sehr die Mutationen den Krebs in seinen gesamten Eigenschaften – inklusive der Tiefe des Therapieansprechens – beeinflussen. Noch erstaunlicher ist es, wie Krebszellen in der Lage sind, sich dem Druck einer zielgerichteten Therapie zu widersetzten. Dies geschieht naturgemäß nicht „gewollt“, Tumorzellen haben ebenso wie gesunde Zellen keine Intelligenz, auch wenn es uns manchmal so erscheinen mag. Es ist vielmehr so, dass ein Tumor ein – vor allem genetisch – heterogener Zellhaufen zu sein scheint mit unterschiedlichen Spezialisierungen.
Ein bestimmtes Medikament mag die Hauptmasse des Tumors töten aber einzelne Zellen besitzen Resistenzmutationen, die sie gegenüber des Medikaments unangreifbar machen – durchaus im Analogie zu einer mikrobiellen Antibiotikaresistenz. Die Mechanismen sind mittlerweile zum Teil entschlüsselt und es gibt bereits erste Folgemedikamente, die in dieser Situation eingesetzt werden können. Der „Kampf“ geht damit in die nächste Runde.
In der Genetik des Tumors liegt letztendlich der Schlüssel zum Verständnis der Krebsentstehung und immer häufiger auch zur passenden Therapie. Die motivierende Entwicklung des Erkenntnisgewinns bzw. die Entwicklung neuer Behandlungsmöglichkeiten ist beim Lungenkarzinom besonders beeindruckend, gilt aber auch in gewissem Maße für weitere solide Tumoren. Interessanterweise sind viele Krebsarten genetisch „verwandt“, indem sie die gleichen Treibermutationen haben. Diese „Verwandtschaft“ ist über anatomische Grenzen hinweg zu beobachten, Darmkrebs, Lungenkrebs, malignes Melanom, Schilddrüsenkarzinom – haben unter Umständen gemeinsame genetische Ursprünge und werden daher zunehmend ähnlich therapiert.
Die Lokalisation der Erkrankung wird weniger wichtig, gleichzeitig steigt die Bedeutung des genetischen Ursprungs der Erkrankung. Wodurch die Mutationen ausgelöst werden, ist in vielen Fällen nicht abschließend geklärt, neben exogenen Noxen (z.B. Rauchen, UV-Licht) kommen auch andere teils erbliche Faktoren in Betracht, wie zum Beispiel ein fehlerhaftes DNA-Reparatursystem.
Um zur Ausgangsfrage zurückzukommen, Krebs ist eine Erkrankung, die genetisch getrieben ist. Fehler in Wachstumsgenen können einer Zelle unkontrollierte Energie zur Zellteilung geben. Viele dieser mutierten Gene, bzw. deren Genprodukte, die Proteine können zielgenau in ihrer Aktivität blockiert werden. Tumorzellen haben die Fähigkeit, sich daran anzupassen und „erfinden“ neue Mutationen und können sich wieder teilen (Rezidiv). Immer neue Medikamente müssen entwickelt werden, die an die veränderten Tumorzellen angepasst sind.
Es bleibt abzuwarten, wie sich die zielgerichtete Therapie weiterentwickelt, und welchen Stellenwert andere Therapiestrategien wie die Immuntherapie in Zukunft innehaben werden. Ein Blick in die Zukunft ist schwierig, aber zielführende Therapieoptionen werden den komplexen genetischen Veränderungen im Tumorgenom Rechnung tragen müssen.